【据《Development》2014 年1月报道】题:发育过程中Crim1通过调节内皮细胞VEGFA 的自分泌信号维持视网膜血管的稳定性(作者Jieqing Fan 等)
血管新生以现有血管通过分枝化形态生长出新血管的突起为特点。血管新生时,一些静止的血管内血管内皮细胞(VECs)被诱导成为端细胞。这些细胞被极化并且伸展伪足去探测微环境信号,并且通过迁移导致新生血管分枝延长。与端细胞相邻的血管内皮细胞变成柄细胞,增殖并促进内腔形成。突起中新芽的融合叫做吻合,促进血管网络的形成。这些初步的血管网络在广泛重塑后变成功能性血管网。而血管新生的失调出现在多种病理过程中,包括癌症、糖尿病视网膜病变、早产儿视网膜病变和年龄相关性黄斑变性等,而抗血管生成的治疗对这些疾病可能有效。
血管内皮生长因子(VEGF) 家族成员是血管发育和内稳态的关键调控者。VEGFA 是在几乎或有病理和非病理血管新生中都不可或缺的前血管生成因子。VEGFA 信号通过血管内皮生长因子受体2(VEGFR2)发挥作用。最近有研究表明VECs 本身能产生VEGFA 并且在VECs 内通过VEGFR2 形成的“ 私有环”对新生血管发挥重要作用。VECs特异性敲除VEGFA 的小鼠出现血管退化相关的出生后死亡现象,暗示血管内稳态中可能存在VEGFA的自分泌效应。虽然已有研究表明内皮细胞在低氧等压力条件下VEGFA 产生上调, 但调节这条通路的配体及下游效应蛋白的分子机制还不是十分清楚。
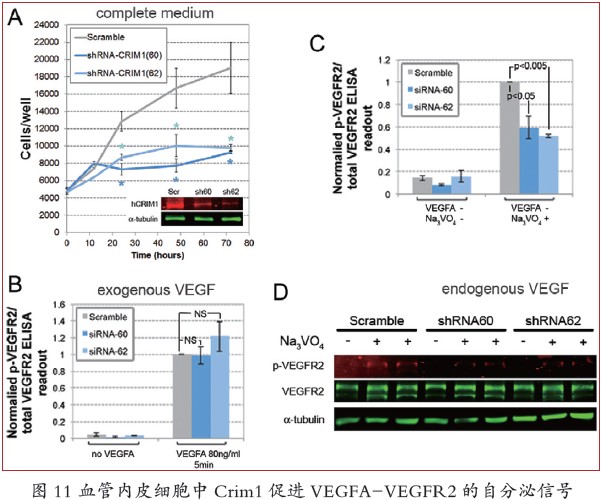
半胱氨酸丰富的运动神经元1(Crim1)表达广泛,并且影响体外血管的形成。小鼠Crim1 突变导致多器官缺陷,包括出血性坏死和肾小球毛细血管扩大等,并于围产期死亡。并有报道表明Crim1 能与VEGFA 结合。在肾小球,Crim1 在足细胞表面调节VEGFA 向内皮细胞的传递。研究人员确定了Crim1 高表达与血管内皮细胞生成的关系。并且发现VECs 条件性敲除Crim1 导致血管扩张的延迟和血管密度的降低。
据此,研究人员在已知的Crim1与VEGFA 的结合能力、Crim1 表达于视网膜血管并且对其发育有重要调控的背景下,提出假说:在视网膜血管系统血管生成依赖于VEGFA,Crim1 调节VEGFA 自分泌活性的假说。
针对以上假说,研究者们发现,VEC 特异条件性的Crim1 和VEGFA 共同杂合子比两者单独杂合子显示出更明显的表型,并且与两者的条件敲除纯合子基本一致。体外培养的人类VECs 中抑制了CRIM1 的表达,从而导致VEGFR2 磷酸化减弱,但这仅限于VECs 被要求依赖于自分泌来源的VEGFA 时。VEGFA 的下调能增强CRIM1 降低VEGFR2 磷酸化的效应,但对外加anti- VEGFA 抗体无响应, 而外加小分子VEGFR2 的激酶抑制剂SU5416 能完全抑制VEGFR2 的磷酸化。
这些结果强烈地证实了CRIM1 加强VEGFA 的自分泌活性,并且这种活性至少部分通过VEGFR2 实现。